1. Objetivo Geral
Verificar experimentalmente a ocorrência de reações de deslocamento entre ácidos e substâncias metálicas.
1.2. Objetivo específico
- Comparar a reatividade entre metais.
- Observar as mudanças nas características físicas das susbst6ancias antes e após o fenômeno.
2. Desenvolvimento Teórico
A reatividade pode ser relacionada com a capacidade de doar elétrons, sua eletropositividade, quanto mais eletropositivo for o metal mais reativo ele é. A série ou a fila de relatividade também organiza os elementos com sua capacidade de se oxidar, quanto mais reativo maior é sua capacidade de oxidar-se.
A seguir temos uma representação da reação química de oxidação desses metais:
Os metais à esquerda da fila de reatividade são extremamente reativos, à direita, pouco reativos e os do meio, moderadamente reativos. Dessa maneira os metais extremamente reativos são fortes agentes redutores por que tem grande facilidade de oxidar deslocando os metais menos nobre de compostos em solução. Note que o hidrogênio foi incluindo nessa fila, mesmo sem ser um metal, porque separa os elementos da fila que reagem com ácido e liberam gás hidrogênio (à direita do hidrogênio) daqueles que não reagem liberando esse gás (à esquerda do H). Os elementos a esquerda do H, com exceção do Au e Pt, reagem somente com ácidos oxidantes, que possuem ânions que são fortes agentes oxidantes.
Metais à direita do magnésio são tão reativos que reagem diretamente com água fria formando hidróxidos desses metais, como é o caso do sódio, já os metais antes do magnésio até o ferro só reagem com água em ebulição ou vapor de água. E os metais a esquerda do ferro antes do hidrogênio não reagem com água, e sim com ácido liberando H2(g).
3. Material e Método
Material
- Tubo de ensaio
- Suporte Universal
- Garra de condensador
- Ácido clorídrico
- Alumínio em aparas
- Zinco em aparas
- Fio de cobre
Metodologia:
1. Colocar
o ácido clorídrico no tubo de ensaio.
2. Adicionar
aparas de zinco no tubo 1 contendo solução de ácido clorídrico.
3. Adicionar
aparas de alumínio no tubo 2 contendo solução de ácido clorídrico.
4. Adicionar
o fio de cobre no tubo 3 contendo solução de ácido clorídrico.
5. Observar
e anotar.
4.1. Zinco metálico em aparas
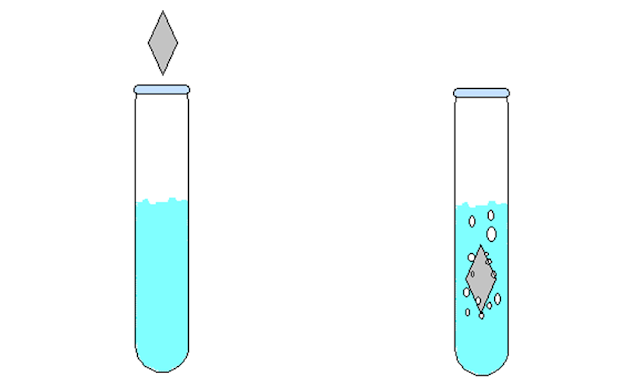
Observou-se que houve formação de bolhas (Figura 1), ocasionada pela liberação do gás hidrogênio, a reação ocorreu por que o zinco é mais reativo que o hidrogênio e dessa maneira o zinco consegue deslocar o hidrogênio da solução de HCl.
 |
| Figura 2. Antes e depois da adição de aparas de alumínio. |
4.3. Cobre metálico em aparas
Observou-se que não ocorreu nenhuma reação (Figura 3) por que o fio de cobre é menos reativo que o hidrogênio.
 |
| Figura 3. Antes e após da adição de fio de cobre. |
5. Conclusão
Diante das atividades experimentais, conclui-se que a reatividade, varia com a posição dos metais na fila de reatividade química. Logo os metais localizados anteriormente ao hidrogênio reagem com ácido clorídrico e os metais após o hidrogênio não reagem com acido clorídrico.
6. Referência
Reatividade química. Disponivel em: < http://www2.fc.unesp.br/lvq/exp07.htm> Acesso em: 01 set. 2011.
Reatividade química. Disponivel em: < Reatividade química. Disponivel em: < http://www2.fc.unesp.br/lvq/exp07.htm> Acesso em: 01 set. 2011.



Nenhum comentário:
Postar um comentário